Madde,
Uzayda yer kaplayan ve kütlesi olan her şeye madde denir.Madde, saf ve saf olmayan madde olmak üzere iki ana gruba ayrılır.
Saf maddeler
Her yerinde aynı özelliğe sahip olan maddelere saf maddedenir.
Saf maddeler aynı cins atom yada moleküllerden meydana gelir.
Saf maddelerin öz kütle, çözünürlük, öz ısı, erime noktası ve kaynama noktası gibi ayırt edici özellikleri vardır.
Saf maddeler, kendi içinde element ve bileşik olarak iki kısma ayrılır.
Element: Aynı cins atomlardan meydana gelen maddeye denir.
Elementler fiziksel veya kimyasal yollarla daha basit maddelere ayrılmaz.
Genel olarak elementler kimyasal özelliklerine göre metal, ametal ve soy gazlar olmak üzere üçe ayrılır.
Bileşikler: İki ya da daha fazla cins atomdan meydana gelen saf maddeye denir.
Bileşikler;
Elementlerin belirli oranlarda birleşmesiyle meydana gelir.
Kendisini oluşturan elementlerin özelliklerinden tamamen farklı özellik taşır.
Kendilerini oluşturan elementlere kimyasal yollarla ayrıştırılabilir.
Saf Olmayan Maddeler (Karışımlar) :Birden fazla maddenin özelliklerini kaybetmeden bir araya gelmesiyle oluşan madde topluluğuna karışımdenir.
Karışımlar homojen veya heterojen olabilir.
Karışım kendini oluşturan maddenin özelliklerini taşır.
Karışımı oluşturan maddelerin belirli bir birleşme oranı yoktur.
Erime, çözünme, süzme gibi fiziksel yöntemlerle ayrıştırılabilir.
Saf değildirler.
Erime ve kaynama noktası, öz ısıları, öz kütle gibi ayırt edici özellikleri yoktur.
Homojen Karışımlar: Özellikleri her yerinde aynı olan ve dışarıdan bakıldığında tek bir madde gibi görülen karışımlardır.Tuzlu su, şekerli su,hava, alaşım homojen karışımlardır.
Heterojen Karışımlar: Özellikleri her yerinde aynı olmayan karışımlardır.Kum - su, yağ - su, ayran karışımları heterojen karışımlardır.
ÖRNEK:
I. Belirli bir hacme sahip olma
II. Saf hâlde bulunma
III. Tek cins atomlardan oluşma
IV. Belirli bir öz kütleye sahip olma
V. Belirli bir kütleye sahip olma
Yukarıdakilerden hangileri, hem element hem bileşikler için ortaktır?
A) Yalnız I B) II, IV C) II, III, V D) I, III, IV, V
ÖRNEK:
I. Hava
II. Ayran
III. Tuzlu su
IV. Kum - su karışımı
V. Şekerli su
Yukarıdakilerden hangileri homojen karışımlara örnek olarak verilebilir?
A) Yalnız I B) II, III C) I, III, V D) II, IV
Maddenin Yapısı ve Atom
Madde, atom adı verilen taneciklerden oluşur.Atom maddenin yapı taşıdır.
Atomun yapısında proton, nötron ve elektron bulunur.
Proton ve nötron atomun çekirdeğinde yer alır. Elektron ise çekirdek etrafında dolanır.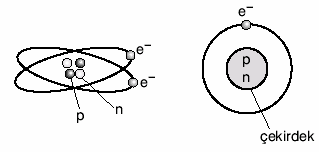
Atomu oluşturan tanecikler belli başlı özellikleri vardır.
Proton: Atomun çekirdeğinde bulunur. (+) yüklü bir parçacıktır. Kütlesi 1 akb’dir.
Nötron: Atomun çekirdeğinde bulunur. Kütlesi hemen hemen protona eşittir. Elektrik yükü taşımaz.Yani yüksüz bir parçacıktır.
Elektron: Atomun çevresinde çok büyük hızla dönen hareketli bir parçacıktır. Elektronlar çekirdek etrafında farklı enerji seviyelerinde dolanır.
Atom çekirdeğinin çapı, atom çapının 100 binde biri kadardır. Atom çekirdeğinde yüklü olarak sadece protonlar bulunduğu için, atomun çekirdek yükü daima (+) artıdır.
1 Karbon atomunun kütlesinin 1/12’sine, 1 atomik kütle birimi adı verilmiştir. Atomik kütle birimi akb ile gösterilir.
1 Karbon atomu = 12 akb’dir.
Kimyasal hesaplamalarda atomların kütleleri gram cinsinden değil, akb cinsinden alınır.
Atom numarası:Bir element atomunun çekirdeğinde bulunan proton sayılarının toplamına, atom numarası adı verilir. Atom numarası Z ile gösterilir.
Z = p
Kütle numarası: Bir atomun çekirdeğindeki proton ve nötron sayılarının toplamı, o atomun kütle numarasını verir. Kütle numarası A ile gösterilir.
Kütle numarası = Proton sayısı + Nötron sayısı
A = p + n
Nötr ve Yüklü Atom: Bir atomdaki proton ve elektron sayıları birbirine eşitse
bu atoma nötr atom denir. Nötr atomda (+) ve (–) yükler birbirine eşittir.
Örneğin nötr karbon atomunda 6 proton 6 elektron vardır. Nötr atomda,
p = e’dir.
Atomlar elektron alıp verebilirler. Ancak çekirdekte bulunan proton ve nötronu alıp veremezler.
ÖRNEK:Nötr bir magnezyum atomunda proton sayısı 12, nötron sayısı 13’tür.
Bu atomun;
a. Elektron sayısı nedir?
b. Kütle numarası nedir?
(–) yüklü atom
Eğer bir atom dışarıdan elektron alırsa, (–) yük sayısı (+) yük sayısından
fazla olur. Bu durumda atom (–) yüklü olur.
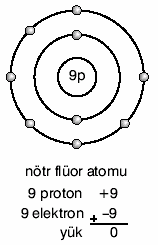
Örneğin nötr flüor atomunun 9 elektronu, 9 protonu vardır.
Flor atomu 1e– alınca 10 elektronlu ve (–) yüklü olur.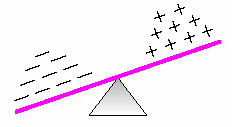
+) yüklü atom
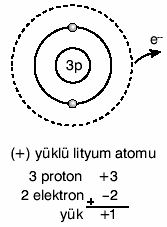
Eğer bir atom bir elektronunu kaybederse, (+)
yük sayısı (–) yük sayısından fazla olur. Bu durumda
atom (+) yüklü olur.
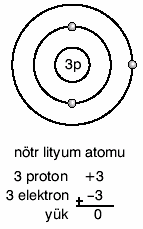
Örneğin nötr lityum atomunun 3 protunu 3 elektronu
vardır. Lityum 1e– verirse 2 elektronlu ve (+)
yüklü olur.
Elementlerin Sembollerle Gösterilmesi
Kimyasal hesaplamalarda maddelerin Lâtince isimleriyle işlem yapmak zordur. Bunun yerine elementlerin Lâtince isimlerinin kısaltmalarından oluşan semboller kullanılır.
Element sembollerinde ilk harf her zaman büyük, varsa diğerleri daima küçük yazılır.
Örneğin;
Hidrojen H, Helyum He, Karbon C
Kalsiyum Ca, Bor B, Berilyum Be
Element sembolünün sol üst köşesine atomun kütle numarası, sol alt köşesine ise atom numarası yazılır.
İyon atom
(+) ya da (–) elektrik yüklü atoma iyon atom denir. İyon yükü element sembolünün sağ üst köşesine yazılır. Eğer atom yüklü değilse herhangi bir ibare konmaz.
Örneğin, nötr X atomu 1e–verdiğinde X atomu +1 yüklü iyon hâline gelir.
(+) yüklü iyona katyon denir.
(–) yüklü iyona anyon denir.
Bir atomun yük miktarı;
İyon yükü = p – e bağıntısından hesaplanabilir.
Örnek:
Bir atomun proton sayısı 15, elektron sayısı 18’dir. Bu atomun yük miktarı nedir?
İyon yükü = p – e İyon yükü = 15 – 18 = –3
Burada (–) işareti atomun dışarıdan elektron aldığını gösterir. Atomun iyon yükü ile birlikte gösterimi 15X–3 şeklinde olur.
İyon hâlindeki bir atom elektron alarak ya da vererek nötr hâle geçebilir.
Örneğin X–1 iyonunun elektron sayısı proton sayısından 1 fazladır. X–1 iyonu daha önce aldığı 1 elektronu geri vererek nötr hâle geçebilir.
X+1 iyonuda daha önce verdiği 1 elektronu alarak nötr hâle geçebilir.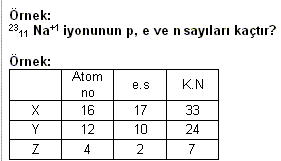
Tabloda verilenlere göre, I. X bir katyondur. II. Y’nin nötron sayısı 12 dir. III. Z bir anyondur.
yargılarından hangileri doğrudur?
A) Yalnız I B) Yalnız II C) I, III D) I, II, III
www.fenokulu.net
-
8. Sınıf fen bilgisi - Madde ve enerji
14 Ekim 2011 Cuma
yazildi.
Tweetle
| Sponsorlu Bağlantılar |



0 yorum :
Lütfen Yorumunuzun anlaşılır ve imla kurallarına uygun olmasına dikkat ediniz.